Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Covalente apolar
Conocido además por enlace covalente puro , o covalente no polar. Se produce por el compartimiento de electrones entre dos o más átomos de igual electronegatividad, por lo que su resultado es 0, y por tanto la distribución de carga electrónica entre los núcleos es totalmente simétrica, por lo que el par electrónico es atraído igualmente por ambos núcleos.. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace covalente apolar.
Ejemplo:
En la molécula de dihidrogeno (H2), cada átomo de hidrógeno tiene la configuración electrónica del estado fundamental 1s1, con la densidad de probabilidad para este único electrón esféricamente distribuida en torno al núcleo del hidrógeno en su primera y única capa o envoltura.Puesto que la capacidad de esta envoltura es de dos electrones, cada átomo hidrógeno tiende a captar un segundo electrón.
H• + •H = H:H o bien H- H
Cuando dos átomos de hidrógeno se acercan uno a otro, el electrón de cada átomo de hidrógeno es atraído por el núcleo del otro átomo de hidrógeno tanto por su propio núcleo.
Si estos dos electrones tienen espines opuestos de forma que pueden ocupar la misma región (orbital), ambos electrones pueden ocupar preferencialmente la región entre los dos núcleos. Porque son atraídos por ambos núcleos.
Los electrones son compartidos entre los dos átomos de hidrógeno, y se forma un enlace covalente simple, ya que esta sustancia es una combinación de átomos que tienen una igual atracción (o afinidad) hacia los electrones de valencia, los átomos compartirán cada uno de sus electrones individuales, existiendo una distribución simétrica de la nube electrónica formando así un enlace covalente no polar o apolar. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia..
Decimos que los orbítales 1s se solapan, así que ambos electrones ahora están en los orbítales de los dos átomos de hidrógeno. Mientras más se aproximan los átomos, más cierto es esto. En este sentido, cada átomo de hidrógeno ahora tiene la configuración del gas noble Helio1s2.
Otros pares de átomos no metálicos comparten pares electrónicos para formar enlaces covalentes apolar como el Cl2, N2, O2, F2, C, etc. El resultado de esta compartición es que cada átomo consigue una configuración electrónica más estable (frecuentemente la misma que la del gas noble más próximo)..
Covalente polar
Enlace covalente polar
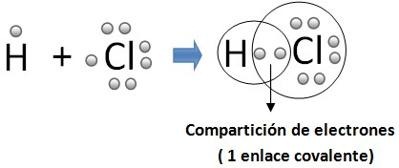
Es una transición entre el enlace iónico puro y el enlace covalente apolar. Se produce por el compartimiento de electrones entre dos o más átomos de diferente electronegatividad, estableciéndose una separación de cargas (que simbolizaremos como d+y d-) o lo que es igual, la distribución de carga electrónica entre los núcleos será asimétrica, pero esta diferencia no llega al punto en que el enlace se torna iónico puro. Son posibles diferentes grados de polaridad del enlace.
Esto ocurre, porque en las sustancias que presentan enlace covalente un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace covalente polar, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones de este tipo de enlace.
La característica más importante del enlace covalente polar, es el grado de simetría en la posición del par electrónico. Esto está primeramente determinado por la diferencia de electronegatividad de los átomos. Cuanto mayor es esta diferencia, más asimétrica es la posición del par de electrones del enlace y más polar el enlace formado.
Así pues, para diferencias de electronegativades mayores de 3 el enlace será predominantemente de carácter iónico, como sucede entre el oxígeno o flúor con los elementos de los grupos 1 y 2 de la tabla periódica de 18 columnas; sin embargo, cuando está entre 0 y 1,7 será el carácter covalente el que predomine, como es el caso del enlace C-H. No obstante, según el químico Raymond Chang, esta diferencia de electronegatividad entre los átomos debe ser 2,0 o mayor para que el enlace sea considerado iónico..
Compartimiento de dos electrones para uno solo átomo
Este tipo de enlace covalente es el llamado enlace covalente coordinado o dativo
Covalente coordinado o dativo
Se produce cuando dos átomos comparten una pareja de electrones, pero dicha pareja procede solamente de uno de los átomos combinados.
El átomo que aporta la pareja de electrones recibe el nombre de donante, y el que los recibe, aceptor. Cuando queremos simplificar la fórmula electrónica se pone una flecha (→) que va del donante al aceptor.
Aunque las propiedades de enlace covalente coordinado son parecidas a las de un enlace covalente normal (dado que todos los electrones son iguales, sin importar su origen), la distinción es útil para hacer un seguimiento de los electrones de valencia y asignar cargas formales. Una base dispone de un par electrónico para compartir y un ácido acepta compartir el par electrónico para formar un enlace covalente coordinado. Por ejemplo:
Ion amonio.jpeg
La formación de ión amonio (NH4+1). El átomo de nitrógeno tiene un par de electrones no compartidos con otro elemento; sin embargo, este par genera un polo negativo que atrae iones positivos como H+1, el cual forma un enlace con ambos electrones que son del nitrógeno.
Enlaces múltiples
Es el compartimiento de más de un par de electrones entre dos átomos durante la formación de los enlaces covalentes, para satisfacer la regla del octeto y los requerimientos de covalencia.
El número de enlaces covalentes formados por un átomo se llama su covalencia. Es decir, la covalencia es igual al número de electrones que el átomo necesita para ser isoelelectrónico con un gas noble. Los valores para algunos de los elementos más comunes son los siguientes: hidrógeno y los halógenos, 1; oxígeno y azufre, 2: nitrógeno y fósforo, 3; carbono y silicio,4.
De esta forma se distingue entre enlace simple o sencillo (los átomos comparten un solo par de electrones de la capa de valencia), enlace doble (los átomos comparten dos pares de electrones de la capa de valencia) o enlace triple (los átomos comparten tres pares de electrones de la capa de valencia). En química orgánica las moléculas que poseen enlace simple reciben el nombre de saturadas y las que contienen enlaces múltiples no saturadas. Ejemplo
Sustancia Tipo de enlace e- de valencia compartidos Produciendo Diagrama de Lewis Diagrama de Couper
H2
Sencillo
2
1 par de electrones
H:H
H-H
CO2
Doble
4
2 pares de electrones
Dioxido de carbono Lewis.jpg
Dioxido de carbono Couper.jpg
N2
Triple
6
3 pares de electrones
N:::N
NΞN
Este a diferencia de los ionicos ocurre cuando los átomos que se combinan comparten los electrones.
ResponderBorrarEsta se da cuando dos electrones, una de cada uno de ellos (átomos) se comparten en la misma magnitud por átomo y llegan a ser uno solo.
El no polar es el que se forma con átomos del mismo tipo y en este la carga eléctrica esta simétricamente distribuida.
El polar se forma con átomos diferentes por lo tanto tienen diferentes electronegatividades esto hace que en el espacio del átomo que tenga mas electronegatividad exista mayor densidad de las cargas eléctricas negativas y esto forma un polo negativo en comparación con el otro que es positivo
En el coordinado los átomos combinados comparten sus electrones pero el par que se necesita para hacer el enlace lo da solo uno, por lo general esto lo hace el átomo que tiene un par de electrones no compartido en su nivel de valencia, para representar esto se utiliza una flechita apuntando a la derecha y esta empieza del átomo que dona electrones hasta el átomo que los recibe, esto se hace para llegar a la configuración del gas raro que es 8.